Giải Hoá 9 Bài 37: Etilen SGK trang 119 ( chính xác nhất) – Tailieu.com

Có thể bạn quan tâm
- Nghị luận về ý nghĩa của cách sống ở thế chủ động (9 Mẫu) – Văn 12
- Máy đo chất lượng không khí Temtop H2 HCHO & TVOC – TKTech.vn
- 6 cách diễn đạt tiếng Anh vay mượn từ nước ngoài bạn nên biết
- Bất động sản tiếng Anh là gì? Tìm hiểu về các đặc trưng của bất động sản
- Tuổi Nhâm Thìn hợp với màu gì và kỵ màu sắc nào nhất ?
Sau giờ học, học sinh sẽ nghiên cứu tính chất vật lý, tính chất hóa học và các kiến thức liên quan đến etilen. Sau đó, bạn áp dụng những gì đã học để giải các bài tập ứng dụng và chứng minh các hiện tượng thực tế có liên quan.
Giải bài tập sgk bài 9 37
119 SGK 9 Trang 1
Tính số liên kết đơn và liên kết đôi giữa các nguyên tử cacbon trong phân tử của chất sau:
a) ch3 – ch3.
b) ch2 = ch2.
c) ch2 = ch – ch = ch2.
Giải pháp thay thế:
a) ch3 – ch3 có một liên kết đơn c – c.
b) ch2 = ch2 có 1 liên kết đôi: c = c.
c) ch2 = ch – ch = ch2 có 2 liên kết đôi: c = c
1 liên kết đơn: c – c.
Giải trang 119 tập 2 SGK Hóa học 9
Điền từ thích hợp “có” hoặc “không” vào cột bên dưới
Giải pháp thay thế:
Giải bài 3 sgk 9 trang 119
Hãy nêu phương pháp hoá học tách khí etilen ra khỏi khí metan để thu được khí metan tinh khiết.
Giải pháp thay thế:
Cho hỗn hợp đi qua dung dịch brom dư thì etilen phản ứng tạo thành đibromometan là chất lỏng ở trạng thái tồn tại trong dung dịch và chỉ có khí metan thoát ra.
ch2 = ch2 + br2 → br – ch2 – ch2 – br.
Giải 4 Trang 119 Cấp 9
Để đốt cháy 4,48 lít khí etilen cần dùng:
a) Có bao nhiêu lít khí oxi?
Xem Thêm : Tứ giác lồi là gì? Định nghĩa & các dạng toán thường gặp – VOH
b) Có bao nhiêu lít không khí chứa 20% oxi theo thể tích? Biết các thể tích khí đo ở điều kiện tiêu chuẩn.
Giải pháp thay thế:
a)Phương trình phản ứng đốt cháy etylen:
c2h4 + 3o2 → 2co2 + 2h2o.
Theo pt no2 = 3. nc2h4 = 0,2 x 3 = 0,6 mol.
vo2 = 0,6 x 22,4 = 13,44 lít.
b) Thể tích không khí = = 67,2 lít.
Lý thuyết tập trung 9 Bài 37: etilen
I. Thuộc tính vật lý
Etylen là chất khí không màu, không mùi, nhẹ hơn không khí, ít tan trong nước.
Hai. Cấu trúc dạng hạt
Trong phân tử etilen, mỗi nguyên tử cacbon liên kết với 2 nguyên tử h, 2 hóa trị còn lại dùng để liên kết 2 nguyên tử cacbon với nhau.
Công thức cấu tạo của etilen: viết tắt là: ch2 = ch2
Do đó, trong phân tử etilen c2h4, giữa hai nguyên tử cacbon có một liên kết đôi.
Lưu ý: Có một liên kết yếu trong liên kết đôi. Liên kết này dễ dàng bị phá vỡ trong phản ứng hóa học.
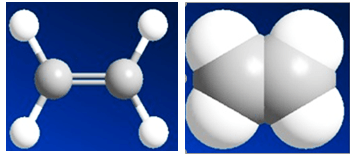
Hình 1: Mô hình rỗng và rắn của phân tử ethylene.
Ba. Tính chất hóa học
1. Phản ứng với oxi:
Khí etilen khi cháy sẽ sinh ra khí co2, hơi nước và tỏa nhiều nhiệt.
Phương trình hóa học:
Xem Thêm : Thành phố Hà Nội có bao nhiêu quận huyện, thị xã?
Lưu ý: Khi đốt cháy khí etilen, số mol khí cacbonic thu được bằng số mol nước.
2. Phản ứng với dung dịch brom
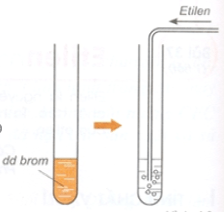
Hình 2: Thí nghiệm phản ứng của etilen và dung dịch brom.
Phương trình hóa học:
Viết tắt: ch2 = ch2 + br2 → br – ch2 – ch2 – br
Nhận xét:
-Liên kết yếu trong liên kết đôi bị phá vỡ và thêm một phân tử brom được kết hợp với mỗi phân tử etilen.
– Phản ứng trên gọi là phản ứng cộng. Ngoài nước brom, ở điều kiện thích hợp etilen có thể tham gia phản ứng cộng với cl2, h2, hbr…
– Chất có liên kết đôi như etilen dễ tham gia phản ứng cộng.
3. Các phân tử etilen liên kết với nhau
Ở điều kiện thích hợp (nhiệt độ, áp suất, xúc tác), các phân tử etilen kết hợp với nhau tạo thành một chất có kích thước và khối lượng rất lớn gọi là polyetylen (pe).
Phương trình hóa học:
Lưu ý:
– Phản ứng trên hoàn toàn là ngẫu nhiên
– Polyetylen là chất không tan trong nước, không độc, là nguồn nguyên liệu quan trọng của ngành nhựa.
Bốn. Áp dụng
– Etylen được dùng trong điều chế axit axetic, etanol, dicloetan, polyme (pe, pvc)…
– Ethylene được dùng để thúc chín trái cây.
►►► Nhấn nút Tải xuống bên dưới ngay để tải dung dịch Hóa học 9 bài 37: etilen sgk trang 119 file pdf về máy miễn phí!
Nguồn: https://xettuyentrungcap.edu.vn
Danh mục: Hỏi Đáp



