Giải bài 1, 2, 3, 4, 5, 6, 7 trang 22 Sách giáo khoa Hóa học 11

Có thể bạn quan tâm
- Đề đọc hiểu Tại Hoàng Hạc lâu, tiễn Mạnh Hạo Nhiên đi Quảng Lăng
- Nghị luận Sống trong đời sống cần có một tấm lòng (13 Mẫu) – Văn 12
- Khái niệm tệ nạn xã hội là gì? Phân loại các loại tệ nạn xã hội?
- Hướng dẫn và bài tập Toán lớp 4 chia một số cho một tích – Vuihoc.vn
- Thông tin liên lạc là gì? Sự bùng nổ của thông tin liên lạc ngày nay
Bài tập 1 trang 22 sgk hóa học 11
Viết phương trình điện phân của các chất sau: k2s, na2hpo4, nah2po4, pb(oh)2, hbro, hf, hclo4.
Xem Thêm : Hóa 10 Bài 6 Kết nối tri thức, Chân trời sáng tạo, Cánh diều
Hướng dẫn giải quyết:
Phương trình điện phân:
a) k2s → 2k+ + s2_
b) na2hpo4 → 2na++. hpo42-
hpo42- \(\rightleftharpoons\) h+ + po43-
c) nah2po4 → na+ + h2po4-
h2po4- \(\rightleftharpoons\) h+ + hpo42-
hpo42- \(\rightleftharpoons\) h+ + po43-
d) pb(oh)2 \(\rightleftharpoons\) pb2+ + 2oh- : phân ly cơ bản
h2pbo2 \(\rightleftharpoons\) 2h+ + pbo22- : phân ly axit
e) hbro \(\rightleftharpoons\) h+ + bro-
g) hf \(\rightleftharpoons\) h+ + f-
h) hclo4 → h+ + clo4-.
bài 2 trang 22 SGK Hóa học 11
[h+] = 0,01 ohms cho giải pháp. Tính [oh-] và pH của dung dịch. Môi trường của dung dịch có tính axit, trung tính hay bazơ? Hãy cho biết màu của quỳ tím trong dung dịch này.
Xem Thêm : Hóa 10 Bài 6 Kết nối tri thức, Chân trời sáng tạo, Cánh diều
Hướng dẫn giải quyết:
[h+]= 1.0.10-2m thì ph = 2 và [oh-] = 1.0. 10-12 mét.
Môi trường axit. Quỳ có màu đỏ.
bài 3 trang 22 SGK Hóa học 11
Độ pH của dung dịch là 9,0. Tính nồng độ mol của các ion h+ và oh- trong dung dịch. Hãy cho biết màu của phenolphtalein trong dung dịch này.
Xem Thêm : Hóa 10 Bài 6 Kết nối tri thức, Chân trời sáng tạo, Cánh diều
Hướng dẫn giải quyết:
ph = 9,0 thì [h+] = 1,0. 10-9 m và [ồ- ] = 1,0.10-5m.
Môi trường thử nghiệm. Trong dung dịch kiềm, phenolphtalein có màu hồng.
bài 4 trang 22 SGK Hóa học 11
Viết phương trình phân tử và ion thu gọn của các phản ứng (nếu có) xảy ra giữa các cặp chất sau trong dung dịch:
a) na2co3 + ca(no3)2
b) feso4 + nah (mỏng hơn)
c) nahco3 + hci
d) không co3+ không
e) k2co3+ Naxi
g) pb(oh)2 (r) + hno3
h) pb(oh)2 (r) + naoh
i) cuso4 + na2s
Xem Thêm : Hóa 10 Bài 6 Kết nối tri thức, Chân trời sáng tạo, Cánh diều
Hướng dẫn giải quyết:
Phương trình ion rút gọn:
a) ca2+ + co32- → caco3
b) fe2+ + 2oh- → fe(oh)2↓
c) hco3- + h+ → co2 + h2o
d) hco3- + oh- → h2o + co32-
e) Không có phương trình ion thu gọn.
g) pb(oh)2(r) + 2h+ → pb2+ + 2h2o
h) h2pbo2(r) + 2oh- → pbo22- + 2h2o
i) cu2+ + s2- → cus↓.
Xem Thêm : Học phí trường Đại học Tôn Đức Thắng – TDTU mới nhất 2022 – 2023
Sách giáo khoa Hóa học 11, Bài giảng 5, Trang 23
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ có thể xảy ra với điều kiện nào sau đây
A. Các chất phản ứng phải được hòa tan.
Các chất phản ứng phải là chất điện li mạnh.
Một số ion trong dung dịch kết hợp với nhau để giảm nồng độ ion của chúng
Phản ứng này là không thể đảo ngược.
Xem Thêm : Hóa 10 Bài 6 Kết nối tri thức, Chân trời sáng tạo, Cánh diều
Hướng dẫn giải quyết:
Chọn c. Một số ion trong dung dịch kết hợp với nhau để giảm nồng độ ion của chúng.
Sách giáo khoa Hóa học 11, Bài giảng 6, Trang 23
Kết tủa cds (Hình 1.7a) được tạo thành trong dung dịch bởi chất nào sau đây?
A. cdci2 + không
cd(no3)2 + h2s
cd(no3)2 + hcl
cdcl2 + na2so4
Xem Thêm : Hóa 10 Bài 6 Kết nối tri thức, Chân trời sáng tạo, Cánh diều
Hướng dẫn giải quyết:
Chọn b. cd(no3)2 + h2s.
Sách giáo khoa Hóa học 11, Bài giảng 7, Trang 23
Viết phương trình hóa học (dạng phân tử và ion) của phản ứng trao đổi ion trong dung dịch tạo thành từng kết tủa sau: cr(oh)3; ai(oh)3; ni(oh)2 (Hình 1.7 b, c , d)
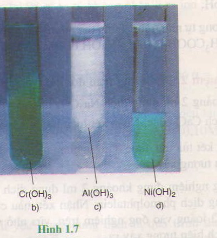
Xem Thêm : Hóa 10 Bài 6 Kết nối tri thức, Chân trời sáng tạo, Cánh diều
Hướng dẫn giải quyết:
cr(no3)3 + 3naoh(vừa phải) → cr(oh)3↓ + 3nano3 ;
alcl3 + 3koh (vừa phải) → al(oh)3↓ + 3kc1 ;
ni(no3)2 + 2naoh → ni(oh)2↓+ 2nano3.
giaibaitap.me
Nguồn: https://xettuyentrungcap.edu.vn
Danh mục: Hỏi Đáp



