Nguyên tắc sắp xếp và Cấu tạo bảng tuần hoàn – Hóa 10 bài 7

Nguyên tắc sắp xếp bảng tuần hoàn
Có thể bạn quan tâm
- Các dạng toán về luỹ thừa với số mũ tự nhiên – toán lớp 6 – hayhochoi
- Bài Thơ Hóa Trị ❤ Bài Thơ Tên Nguyên Tố Hóa Học Lớp 8
- Học Phí Trung Tâm Anh Ngữ Apollo Junior – DGT – Đánh Giá Trường
- Các vị trí trong bóng đá ĐẦY ĐỦ – CHI TIẾT nhất
- 99+ Hình nền hoa đẹp cho điện thoại vô cùng chất – Bảng Xếp Hạng
Vậy các nguyên tố hoá học được xếp như thế nào trong bảng tuần hoàn các nguyên tố hoá học? Nêu cấu trúc bảng tuần hoàn các nguyên tố hóa học? Hãy cùng chúng tôi tìm hiểu qua bài viết sau.
I. Quy tắc sắp xếp bảng tuần hoàn
Việc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn dựa trên 3 nguyên tắc:
– Quy tắc 1: Các nguyên tố được xếp thẳng hàng theo chiều tăng của điện tích hạt nhân.
– Quy tắc 2: Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành đường ngang (chu kì).
– Nguyên tắc 3: Các nguyên tố có cùng số electron hóa trị (các electron có khả năng tham gia hình thành liên kết hóa học) được xếp vào một cột (nhóm) .
Electron hóa trị là các electron có khả năng tham gia hình thành liên kết hóa học (electron lớp ngoài cùng hay lớp dưới lớp chưa no).

Hai. Cấu trúc của bảng tuần hoàn các nguyên tố hóa học
1. Ô phần tử
– Mỗi nguyên tố hóa học được xếp vào một ô của bảng, gọi là ô nguyên tố.
– Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó (= số e = số p = số đơn vị điện tích hạt nhân).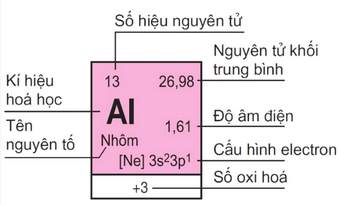
2. Vòng lặp
• Định nghĩa: Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, xếp theo chiều điện tích hạt nhân tăng dần.
+số chu kì trùng với số lớp electron của nguyên tử nguyên tố của chu kì này.
– Kỳ: 1, 2, 3 là các kỳ nhỏ
– Chu kỳ: 4, 5, 6, 7 là các chu kỳ lớn
– Ví dụ: 12mg: 1s22s22p63s2
⇒ mg thuộc chu kì 3 vì có 3 lớp electron.
*Nhận xét:
– Các nguyên tố cùng chu kỳ có cùng số lớp electron và cùng số chu kỳ.
– Kim loại kiềm đầu chu kỳ, halogen cuối chu kỳ (trừ chu kỳ 1); khí trơ cuối chu kỳ.
– Hai hàng cuối cùng của bảng là hai nhóm nguyên tố có cấu hình electron đặc biệt: Lantan và Actini.
Lantanit: 14 nguyên tố sau chu kỳ 6 la (z = 57).
Actinide: 14 nguyên tố sau chu kỳ 7 ac (z = 89).
3. Nhóm phần tử
• Định nghĩa: Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử của chúng có cấu hình điện tử tương tự nhau và do đó có tính chất hóa học gần giống nhau, được sắp xếp thành một nguyên tố.
• Có 2 nhóm phần tử: nhóm a và nhóm b:
* Nhóm A:
– Nhóm a gồm 8 nhóm từ ia đến viiiia.
– Một nhóm phần tử bao gồm các phần tử s và p:
+Nguyên tố s: Nhóm ia (kim loại kiềm, trừ h) và nhóm iia (kim loại kiềm thổ).
+ p phần tử: Các nhóm từ iiia đến viiia (ngoại trừ he).
– stt nhóm a = tổng số e lớp ngoài cùng = số electron hóa trị
Cấu hình electron hóa trị chung của + nhóm:
→ nsanpb
→ dk:1≤a≤2; 0≤b≤6
+nhóm thứ tự a=a+b
Xem Thêm : Lịch thi tốt nghiệp THPT Quốc gia 2023 – Hoatieu.vn
→Nếu a+b≤3 kim loại
→Nếu 5≤a+b≤7phi kim loại
→ Nếu a+b=8 khí trơ
– Ví dụ:→ na (z=11): 1s22s22p63s1 ⇒ ia
→ o (z=8): 1s22s22p4 đã qua
*Nhóm b:
– Nhóm B gồm 8 nhóm, được đánh số thứ tự từ trái sang phải trong bảng tuần hoàn iib đến viiib, rồi ib và iib.
– Nhóm b chỉ chứa các yếu tố từ thời kỳ vĩ đại.
– Nhóm b gồm phần tử d và phần tử f (ở 2 hàng cuối của bảng).
-nhóm stt = tổng số electron lớp ngoài cùng = số electron hóa trị
(Ngoại lệ: Hóa trị e = 9.10 thuộc nhóm viiib)
Cấu hình electron hóa trị của + nguyên tố d:
→ (n−1)dansb
→ tk:b=2;1≤a≤10
→ if a+b<8 ⇒ stt group =a+b or: phần tử trong nhóm (a+b)b
→if a+b=8,9,10⇒stt group=8 hoặc: phần tử thuộc nhóm viiib
→ if a+b>10 ⇒ stt group =(a+b)−10 or: phần tử của nhóm (a+b-10)b
• Khối phần tử s, p, d, f
+ khối phần tử s: gồm các phần tử thuộc nhóm ia và iia
– là nguyên tố có electron cuối cùng điền vào phân lớp s.
– Ví dụ: 11na:1s22s22p63s1
+ khối phần tử p: Bao gồm các phần tử từ họ iiia đến viiia (trừ he).
– là nguyên tố có electron cuối cùng được điền vào phân lớp p.
– Ví dụ: 13al: 1s22s22p63s2 3p1
+ khối phần tử d: Chứa các phần tử nhóm b.
– là nguyên tố có electron cuối cùng được điền vào phân lớp d.
– Ví dụ: 26fe:1s22s22p63s2 3p63d64s2
+Khối lượng của nguyên tố f: Gồm lantan và actinua.
– là nguyên tố có electron cuối cùng điền vào phân lớp f.
– Ví dụ: 58ce:1s22s22p63s2 3p63d104s24p64f25s25p66s2
iii.Thực hành vận dụng bảng tuần hoàn các nguyên tố hoá học
* bài 1 trang 35 sgk 10:Các nguyên tố thuộc chu kỳ 6 có số lớp electron trong nguyên tử là:
A. 3;b.5;c. 6;d.7;
Chọn câu trả lời đúng.
Hãy nhớ rằng: số chu kỳ bằng số lớp vỏ electron
Số nhóm bằng e hóa trị
* Giải pháp:
– Đáp án đúng: c. 6;
Số lớp electron của một nguyên tố là chu kì của nguyên tố đó.
* bài 2 trang 35 sgk 10:Trong bảng tuần hoàn nguyên tố, số chu kì lớn và nhỏ lần lượt là:
Xem Thêm : Hướng dẫn soạn nhạc bằng phần mềm Musescore “dễ như ăn cháo”
A. 3 và 3;b.3 và 4;c. 4 và 4; d. 4 và 3;
Chọn câu trả lời đúng.
* Giải pháp:
– Đáp án đúng: b. 3 và 4;
* Bài 3 trang 35 sgk 10:Các số nguyên tố thuộc chu kỳ 3 và 5 là:
A. 8 và 18;b.18 và 8;c. 8 và 8; d. 18 và 18;
Chọn câu trả lời đúng.
* Giải pháp:
– Đáp án đúng: a. 8 và 18;
* bài 4 trang 35 sgk 10:Trong bảng tuần hoàn các nguyên tố, nguyên tắc sắp xếp các nguyên tố là:
A. Chiều tăng điện tích hạt nhân.
Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thành một hàng.
a,b,c.
Chọn câu trả lời đúng.
* Giải pháp:
– Chọn câu trả lời: d. a,b,c.
* Bài 5 trang 35 sgk 10:Tìm sai trong các câu sau:
A. Bảng tuần hoàn chứa các nguyên tố, chu kỳ và nhóm.
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần.
Bảng tuần hoàn có 7 tiết. Số thứ tự của chu kỳ bằng số lớp electron dưới lớp trong nguyên tử.
Bảng tuần hoàn các nguyên tố có 8 nhóm a và 8 nhóm b.
* Giải pháp:
– Câu sai: c.Bảng tuần hoàn có 7 chu kỳ. Số thứ tự của chu kỳ bằng số lớp electron dưới lớp trong nguyên tử.
* bài 6 trang 35 sgk hóa học 10:Em hãy nêu nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học.
* Giải pháp:
– Quy tắc 1: Các nguyên tố được sắp xếp theo chiều điện tích hạt nhân tăng dần.
– Quy tắc 2: Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
– Quy tắc 3: Các nguyên tố có electron hóa trị xếp thành hàng.
* Bài 7 trang 35 sgk 10: a) Nhóm nguyên tố là gì?
b) Bảng tuần hoàn có bao nhiêu cột?
c) Có bao nhiêu nhóm trong bảng tuần hoàn?
d) Có bao nhiêu nhóm b trong bảng tuần hoàn? Nhóm b có bao nhiêu cột?
e) Những nhóm nào chứa phần tử s? Những nhóm nào chứa nguyên tố p? Nhóm nào chứa nguyên tố d?
* Giải pháp:
a) Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử của chúng có cấu hình electron tương tự nhau nên có tính chất hóa học xấp xỉ nhau và được xếp thành một hàng.
b) Bảng tuần hoàn các nguyên tố có 18 cột.
c) Bảng tuần hoàn có 8 nhóm a.
d) Bảng tuần hoàn các nguyên tố có 8 nhóm b, gồm 10 cột.
e) Nhóm ia và iia chứa phần tử s, nhóm iiia đến viiia (trừ he) chứa phần tử p. Nhóm 3ib đến iib (từ trái sang phải trong bảng tuần hoàn) chứa nguyên tố d.
Nguồn: https://xettuyentrungcap.edu.vn
Danh mục: Hỏi Đáp

